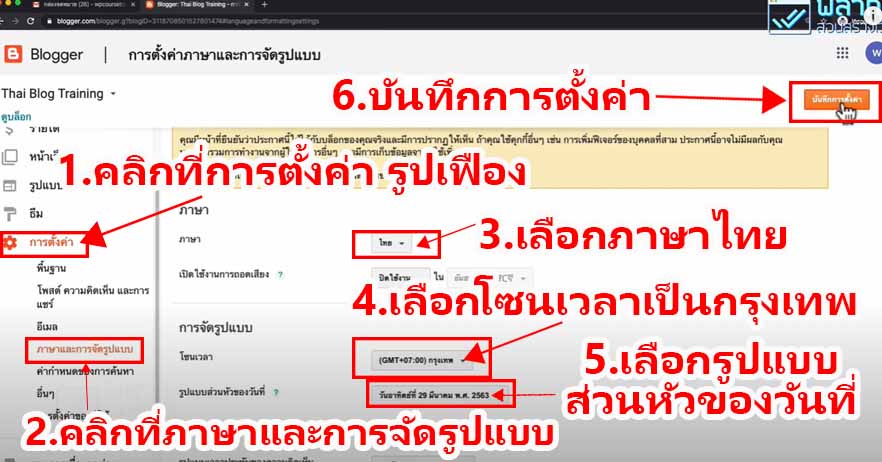
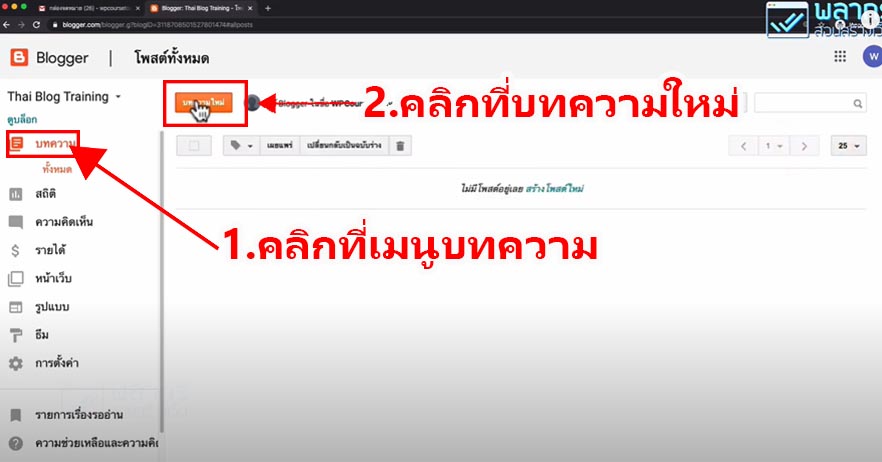
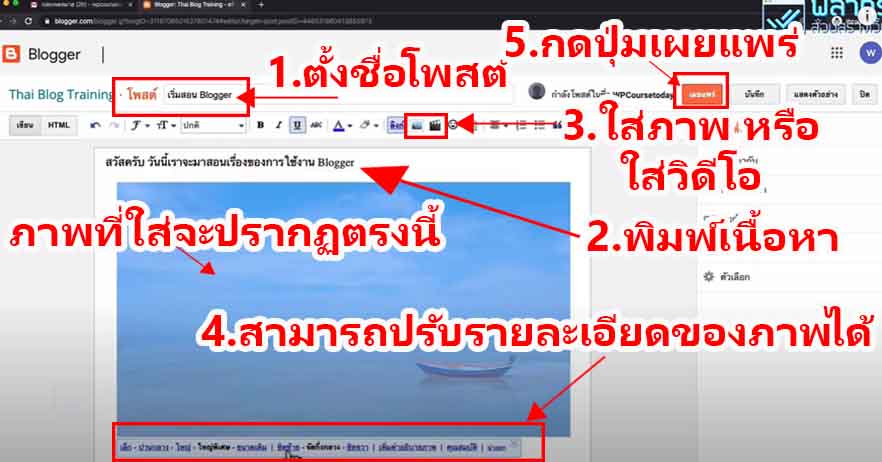
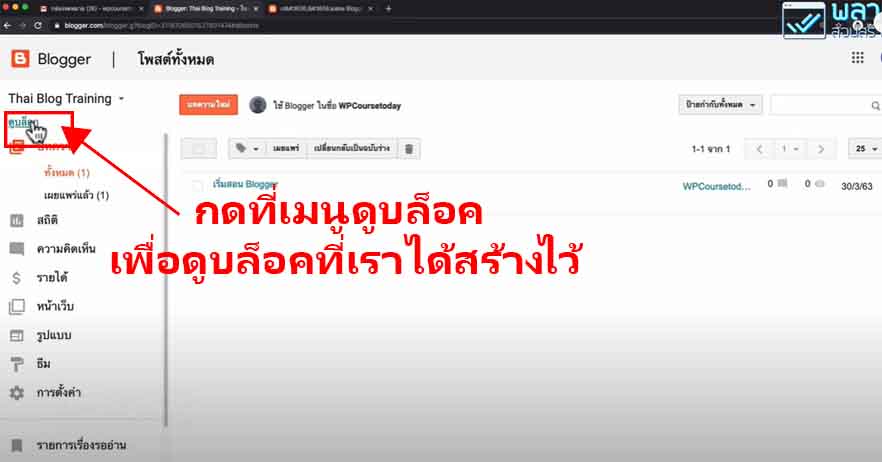
THE BLUE BOTTLE EXPERIMENT
การทดลองขวดสีน้ำเงิน (The blue bottle experiment)
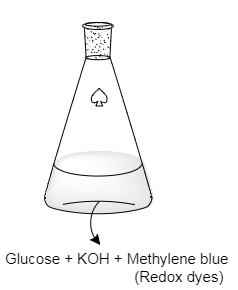
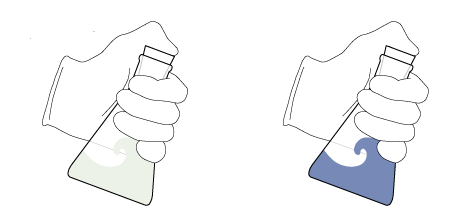
คือ ปฏิกิริยาเคมี สารละลายในน้ำที่มีส่วนประกอบของกลูโคส, โซดาไฟ, เมทิลีนบลู (methylene blue) และอากาศเล็กน้อยถูกเขย่าในขวดที่ปิดอยู่ จากนั้นสารละลายได้เปลี่ยนจากที่ไม่มีสีเป็นสีน้ำเงินและกลับไปเป็นไม่มีสีอีกครั้งเมื่อถูกตั้งไว้ไม่นาน เมื่อเขย่าอีกครั้ง วัฏจักรนี้สามารถเกิดซ้ำได้หลายรอบ การทดลองนี้เป็นการสาธิตแบบดั้งเดิมและสามารถนำไปใช้ได้ในหลักสูตรวิชาห้องปฏิบัติการและเพื่อเป็นการทดลองทางเคมีเบื้องต้น ปฏิกิริยานี้นำไปใช้ได้กับน้ำตาลรีดิวซ์ชนิดอื่นนอกจากกลูโคส และสามารถใช้ได้กับสีย้อมรีดิวซ์ตัวอื่นเช่นกัน
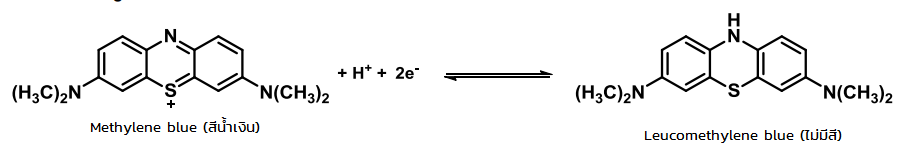
สารละลายในน้ำของปฏิกิริยาแบบดั้งเดิมประกอบด้วย กลูโคส โซดาไฟ และเมทิลีนบลู อินอลเลตของกลูโคสถูกสร้างในขั้นตอนแรก ส่วนอันดับต่อไปเป็นปฏิกิริยารีดอกซ์ของอินอลเลตด้วยเมทิลีนบลู กลูโคสถูกอ็อกซิไดซ์เป็นกรดกลูโคนิก (Gluconic acid) ซึ่งเป็นโซเดียมกลูโคเนทในสารละลายภาวะด่าง เมทิลีนบลูถูกรีดิวซ์ไปเป็น leucomethylene blue ซึ่งไม่มีสี
หากมีออกซิเจนเพียงพอ leucomethylene blue จะถูกอ็อกซิไดซ์ไปเป็นเมทิลีนบลูและสารละลายจะกลับมามีสีฟ้าอีกครั้ง ปริมาณของออกซิเจนนั้นเพิ่มได้โดยการเขย่าสารละลาย เมื่อตั้งไว้ การรีดิวซ์ของกลูโคสจากสีย้อมรีดอกซ์ได้ทำให้สีของสารละลายหายไปอีกครั้ง ปฏิกิริยาเป็นปฏิกิริยาอันดับหนึ่งในกลูโคส เมทิลีนบลูและไฮดรอกไซด์ไอออน และเป็นเป็นปฏิกิริยาอันดับศูนย์ในอ็อกซิเจน
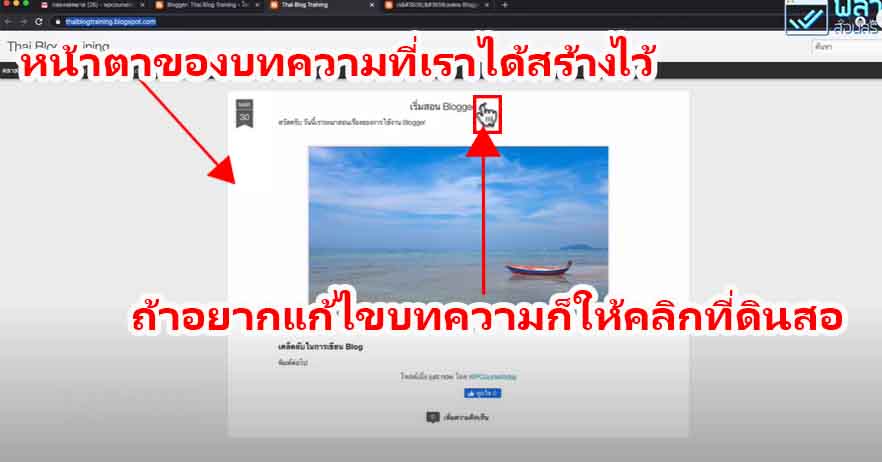
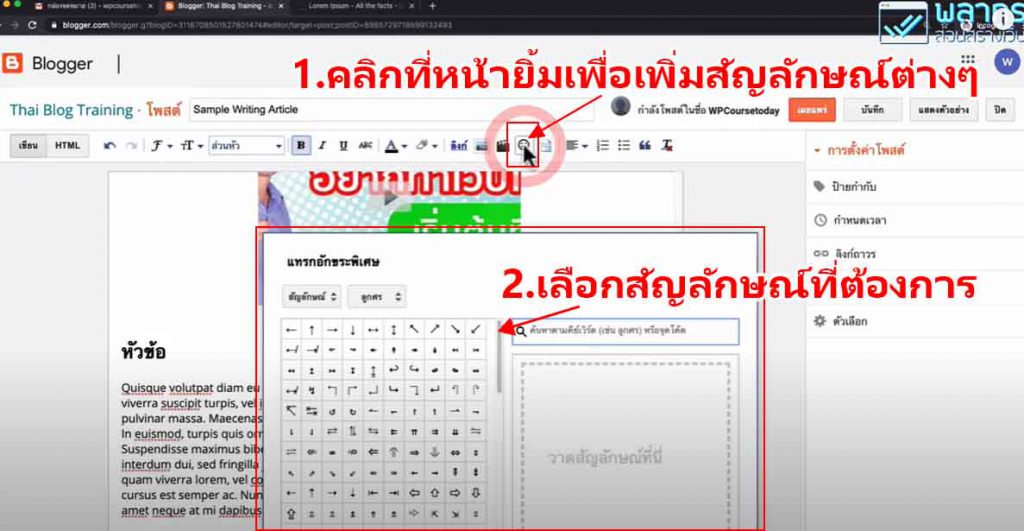
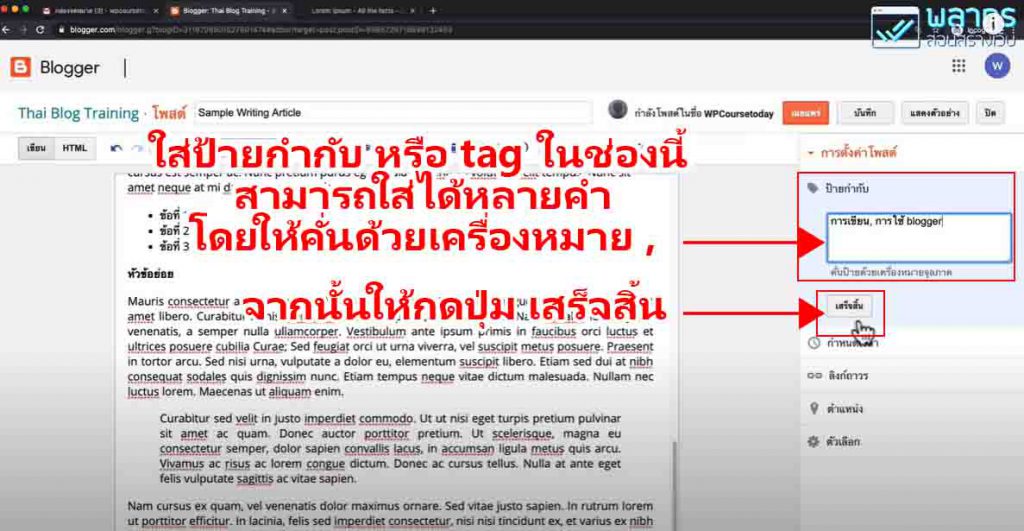
วิธีการทดลอง
อันดับเเรกเริ่มจากสารละลายที่อยู่ในขวดประกอบด้วยอะไรบ้าง
- Glucose : สารตั้งต้นไม่มีสี เป็น Reducing sugar (มีหมู่อัลดีไฮด์) สามารถถูกออกซิไดซ์กลายเป็นกรดได้ (เช่นกลูโคสกลายเป็น gluconate ion) เป็นพระเอกของปฎิกิริยานี้ (ในงานวิจัยพี่เฌอใช้เป็น Dextrose ซึ่งก็เป็นน้ำตาลเหมือนกันจ้า )
- Potassiam hydroxide (KOH) มีฤทธิ์เป็นเบสใช้เป็นตัวเร่งปฎิกิริยาทำให้เกิดได้เร็วขึ้น
- Methylene blue (Redox dyes) เป็นอินดิเคเตอร์ (ซึ่งถ้าเป็นอินดิเคเตอร์สารอื่นก็จะได้สีต่างๆขึ้นอยู่กับสีของอินดิเคเตอร์)
ภายในขวดนั้นเกิดการรับเเละจ่าย e– ระหว่าง น้ำตาลกลูโคส กับ Methylene blue โดยที่ น้ำตาลทำหน้าที่จ่าย e– (เมื่อกลูโคสอยู่ในสารละลายเบสจะมีสมบัติเป็นตัวรีดิวซ์ทำให้ e– หลุด) เเละเมื่อเติม Methylene blue ลงไปจะทำหน้าที่รับ e– ทำให้เปลี่ยนเป็นไม่มีสี เรียกว่า Leucomethylene blue (จากตอนเเรกเป็นสีฟ้าพอเติมลงไปไม่มีสี)
สมการ รับ-จ่าย e– ของ Methylene blue
ขอขอบคุณรูปภาพจาก : บทความวิชาการ การทดลองขวดสีน้ำเงิน The Blue Bottle Experiment
ขอขอบคุณรูปภาพจาก MEL science
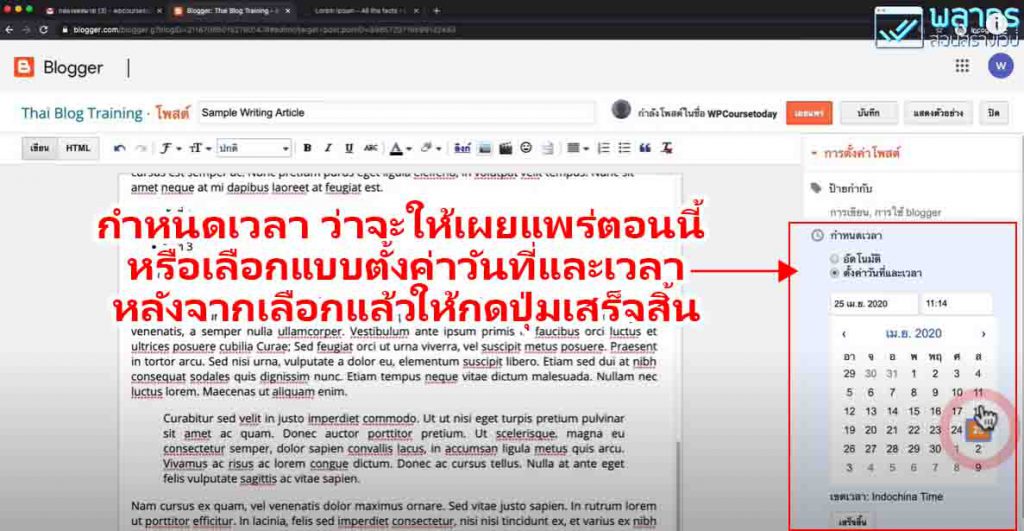
คำตอบคือเป็นการเพิ่มออกซิเจนให้กับระะบบเพราะถึงเเม้จะเป็นระบบปิด (ปิดฝาขวดไว้) เเต่ในขวดก็ยังมีเเก๊สออกซิเจนอยู่ เมื่อเขย่าขวดจะทำให้ออกซิเจนในสารละลายเพิ่มขึ้น (อากาศละลายลงในสารละลาย เกิดได้เร็วเมื่อเขย่าขวด) โดยที่รอบนี้จะสลับกันคือ Leucomethylene blue จะจ่าย e– ให้กับ O2 (รับ e–) ทำให้ methylene blue ถูกออกซิไดซ์กลับคืนเป็นสีฟ้า
เมื่อตั้งทิ้งไว้ให้ออกซิเจนระเหยออก methylene blue จะถูกรีดิวซ์ด้วยน้ำตาลกลูโคสในสภาวะที่ไม่มีออกซิเจนทำให้กลับไปเป็นสารละลายใสไม่มีสี แต่เมื่อสังเกตุดูในคลิปตรงบริเวณผิวสัมผัสกับอากาศจะยังเห็นเป็นสีน้ำเงินอยู่เนื่องจากเป็นจุดที่สัมผัสกับออกซิเจน
การทดลองนี้มีความน่าสนในเป็นอย่างมาก เราสามารถทำให้สีของ methylene blue กลับไป-กลับมาได้หลายครั้ง(จนกว่ากลูโคสจะหมดเปลี่ยนไปเป็น gluconate ion) และยังแสดงถึงสมดุลของปฏิกิริยารีดอกซ์อีกด้วย เเต่มีแค่สีหายเเต่สารไม่ได้หาย (ตัวสาร methylene blue ยังอยู่เเค่สีถูกทำให้หายไป(ถูกรีดิวซ์)ด้วยกลูโคส )
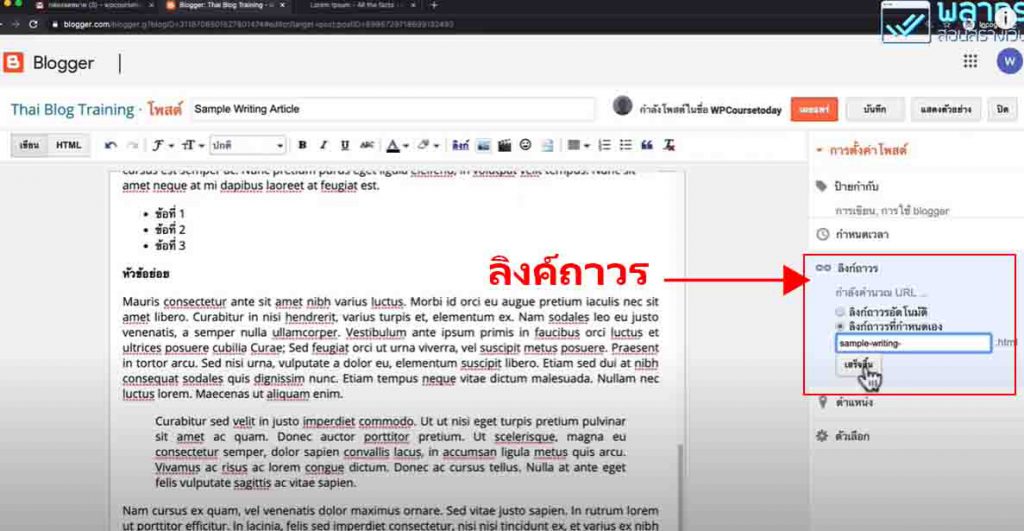
ขอขอบคุณวีดีโอจาก MEL Science
Scientific description


Why does the solution become colorless?
Initially, the solution contains the components for a potential chemical reaction. Glucose itself is more than happy to surrender its electrons. The oxygen dissolved in the water would be delighted to accept these electrons. Interestingly enough, though, oxygen isn't that willing to interact with glucose. And methylene blue can help: this colored compound acts as a carrier in our experiment, taking electrons from glucose and passing them to oxygen. However, at a certain point, the oxygen in the solution runs out, leaving methylene blue in an awkward position: it’s taken electrons from glucose, but has nowhere to pass them on to. When this happens, methylene blue cannot turn blue anymore and has no choice but to stay colorless.
Methylene blue:

Why does the solution turn blue again?
We can saturate the solution again with oxygen from the air above the solution. When the flask is shaken, oxygen from the air dissolves in the solution. The reaction can then proceed until all the oxygen available in the solution is spent again. However, this trick cannot be repeated endlessly. Since the flask is tightly sealed, sooner or later all the oxygen from the air will be depleted, and the solution will then remain colorless even when shaken. Nevertheless, the process can be reactivated by opening the flask to let some more air in.
Why did we add an alkali to the glucose aqueous solution?
By adding sodium hydroxide NaOH aqueous solution, we created an alkaline environment. Methylene blue needs an alkaline environment in order to accept electrons from glucose; otherwise, the reaction will not proceed, and the solution will remain blue. You can check this condition by conducting the experiment without NaOH.
Sodium hydroxide

Why is it so important to seal the flask tightly?
First and foremost, you’ll be able to shake the flask without sending any liquid flying.
Moreover, in sealing the flask we are preventing ambient air from entering, and ensuring that the oxygen in the ambient air will not have access to our solution either. This is why the color can only be restored by shaking the flask (see Why does the solution turn blue again?). The most diligent observers may notice that the blue tint doesn’t disappear completely after the first shake, but remains at the border between the solution and air in the flask (along the so-called meniscus) and forms a nice blue fringe. The same would happen if the flask were left open. This is caused by a high concentration of oxygen present in the air above the solution. The oxygen permeates the liquid-gas interface and converts methylene blue to its colored form. However, as the oxygen supply in the flask is gradually depleted, this border gets increasingly thinner and finally disappears.
ที่มา:https://melscience.com/US-en/chemistry/experiments/blue-bottle-us/
Using other redox indicators
Redox indicators other than methylene blue can be used to present other colours and make the demonstration really striking. In each case add the stated amount of indicator to the basic recipe of 10 g of glucose and 8 g of potassium hydroxide in 300 cm3 of water. Mixtures of the dyes can also be used.
Phenosafranine
This is red when oxidised and colourless when reduced. Use about 6 drops of a 0.2% solution in water for a bottle that goes pink on shaking and colourless on standing. The initial pink colour takes some time to turn colourless at first. A mixture of phenosafranine (6 drops) and methylene blue (about 20 drops of the 0.1% solution in ethanol) gives a bottle which will turn pink on gentle shaking through purple with more shaking and eventually blue. It will reverse the sequence on standing.
Indigo carmine
Use 4 cm3 of a 1% solution in water. The mixture will turn from yellow to red-brown with gentle shaking and to pale green with more vigorous shaking. The changes reverse on standing. These colours are those of traffic lights.
Resazurin
IRRITANT – see CLEAPSS Hazcard HC032. Use about 4 drops of a 1% solution in water. This goes from pale blue to a purple-pink colour on shaking and reverses on standing. On first adding the dye, the solution is dark blue. This fades after about one minute.
ที่มา:https://edu.rsc.org/experiments/the-blue-bottle-experiment/729.article?fbclid=IwAR2dq38z0WTWEFGcNnAz17OKrEIUbHx2CrpPi4kxOqFqB0rDWjT91zUCCjM
ที่มา:https://royalsocietypublishing.org/cms/asset/32ff9f71-a08d-4a8e-8bd9-6392c4d802bf/rsos170708f02.jpg

:max_bytes(150000):strip_icc():format(webp)/GettyImages-1035705314-4cb9ae3d16d4484d962ef78adaddc875.jpg)